Neste tópico vamos abordar quatro modelos atômicos: Dalton, Thomson, Rutherford e Borh. Eles estão em ordem de evolução, ou seja, o primeiro modelo atômico foi proposto por Dalton e assim sucessivamente.
Apesar de o primeiro modelo atômico ter sido proposto por Dalton, a ideia de que a matéria era formada por partes menores surgiu no século V a.C. com Demócrito. A palavra átomo é de origem grega "a + thomos", que significa "sem divisão".
- Átomos são
maciços, indivisíveis e indestrutíveis.
- Átomos
iguais apresentam propriedades iguais e átomos diferentes apresentam
propriedades diferentes (Átomos identificados pela massa atômica).
- Átomos
podem se combinar em proporções bem definidas
para formar compostos estáveis (moléculas).
- Modelo
Atômico de Dalton (“Bola de Bilhar”)
Pasta
positiva com elétrons (partículas subatômicas de carga negativa) incrustados. Modelo Atômico
de Thomson (“Pudim de Passas”).
-
Experimentos de espalhamento de partículas alfa;
- O átomo
seria formado por um núcleo positivo, que seria muito pequeno em relação ao
todo, mas teria praticamente toda massa do átomo;
-Ao redor do
núcleo, os elétrons descreveriam órbitas circulares em altas velocidades, para
não serem atraídos e caírem sobre o
núcleo.
- A
eletrosfera — local onde se situam os elétrons — seria cerca de dez mil vezes
maior do que o núcleo atômico, e entre
eles haveria um espaço vazio.
·
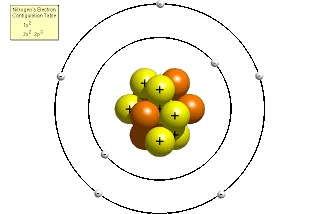
Bohr (1913) ou (Rutherford - Bohr)
- Estudo
baseado nos espectros de emissão e absorção
dos elementos e na Teoria Quântica de Max Planck (1900).
Postulados:
“Os elétrons
movem-se em órbitas circulares em torno do
núcleo atômico central.”
“Quando os
elétrons passam de uma órbita para outra,
um quantum de energia é absorvido ou emitido.”




Nenhum comentário:
Postar um comentário